O Que É Oxirredução: Número De Nox, Reações E Exemplos – Beduka – O Que É Oxirredução: Número De Nox, Reações E Exemplos – Beduka? A oxirredução, ou reação redox, é um processo fundamental em química que envolve a transferência de elétrons entre espécies químicas. Compreender esse conceito é crucial para analisar uma vasta gama de fenômenos, desde a corrosão de metais até os processos metabólicos em seres vivos. Neste estudo, exploraremos os conceitos fundamentais de oxidação e redução, o cálculo do número de oxidação (Nox), diferentes tipos de reações redox e exemplos práticos que demonstram a sua relevância.
A oxidação e a redução são processos simultâneos e complementares. A oxidação caracteriza-se pela perda de elétrons por um átomo, íon ou molécula, enquanto a redução implica o ganho de elétrons. Agentes oxidantes são substâncias que recebem elétrons, causando a oxidação de outra espécie, enquanto os agentes redutores cedem elétrons, promovendo a redução de outra espécie. A variação do número de oxidação (Nox) dos átomos envolvidos serve como um indicador chave para identificar e quantificar a transferência de elétrons durante a reação redox.
Conceitos Fundamentais de Oxirredução
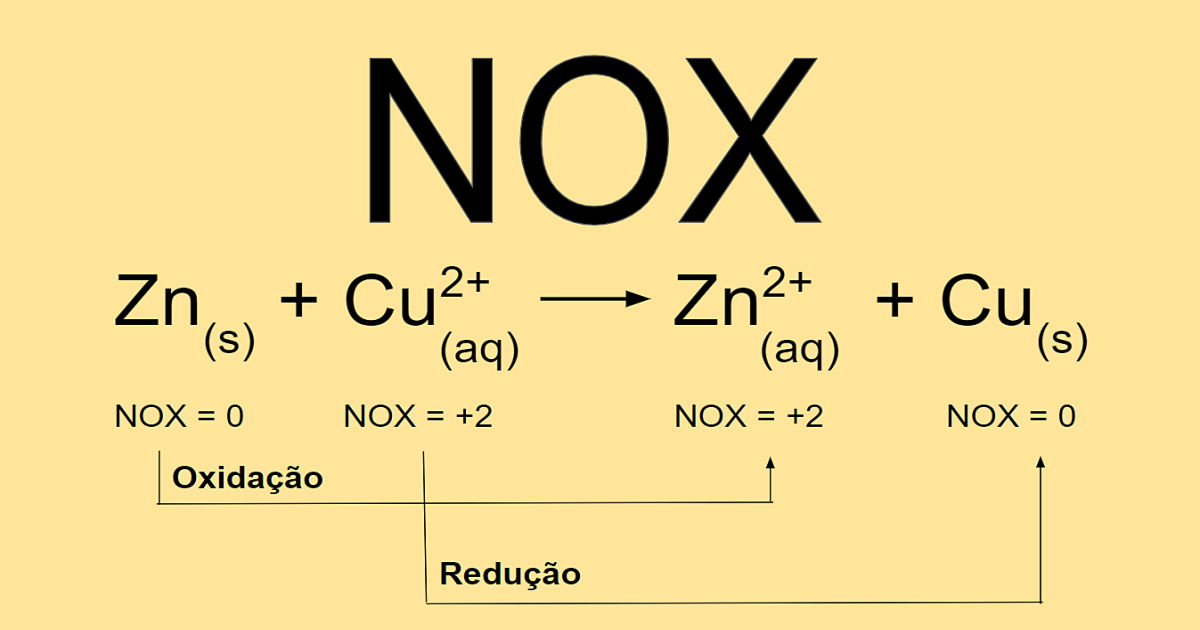
Oxirredução, também conhecida como reação redox, descreve um processo químico que envolve a transferência de elétrons entre espécies químicas. Essas reações são fundamentais em diversos processos naturais e industriais, desde a respiração celular até a produção de energia elétrica em baterias. A compreensão dos conceitos básicos de oxidação e redução é crucial para a análise e previsão do comportamento de muitas reações químicas.
Oxidação e redução são dois processos complementares que ocorrem simultaneamente. Oxidação corresponde à perda de elétrons por um átomo, íon ou molécula, enquanto redução corresponde ao ganho de elétrons por um átomo, íon ou molécula. É importante notar que a oxidação de uma espécie sempre acompanha a redução de outra, e vice-versa, mantendo a neutralidade elétrica do sistema.
A transferência de elétrons resulta em mudanças no número de oxidação (Nox) dos átomos envolvidos.
Agentes Oxidantes e Redutores
Agentes oxidantes são substâncias que recebem elétrons em uma reação redox, causando a oxidação de outra substância. Eles são reduzidos durante o processo. Por outro lado, agentes redutores são substâncias que doam elétrons em uma reação redox, causando a redução de outra substância. Eles são oxidados durante o processo. A força de um agente oxidante ou redutor é determinada pelo seu potencial de redução, uma medida da sua tendência a ganhar ou perder elétrons.
Por exemplo, na reação entre o zinco metálico (Zn) e o íon cobre(II) (Cu 2+), o zinco atua como agente redutor, doando dois elétrons para o íon cobre(II), que atua como agente oxidante. A equação da reação é: Zn(s) + Cu 2+(aq) → Zn 2+(aq) + Cu(s). O zinco é oxidado (perde elétrons), enquanto o íon cobre(II) é reduzido (ganha elétrons).
Outro exemplo é a combustão do metano (CH 4), onde o metano atua como agente redutor e o oxigênio (O 2) como agente oxidante. A equação balanceada é: CH 4(g) + 2O 2(g) → CO 2(g) + 2H 2O(l). O carbono no metano sofre oxidação (aumento do Nox), enquanto o oxigênio sofre redução (diminuição do Nox).
Comparação entre Reações de Oxidação e Redução
A tabela a seguir resume as diferenças-chave entre reações de oxidação e redução:
| Tipo de Reação | Definição | Exemplo | Mudança no Nox |
|---|---|---|---|
| Oxidação | Perda de elétrons; aumento do número de oxidação (Nox). | Fe2+ → Fe3+ + e– | Aumento do Nox (de +2 para +3) |
| Redução | Ganho de elétrons; diminuição do número de oxidação (Nox). | Cl2 + 2e– → 2Cl– | Diminuição do Nox (de 0 para -1) |
| Oxidação | Perda de elétrons; aumento do número de oxidação (Nox). | 2H2 → 4H+ + 4e– | Aumento do Nox (de 0 para +1) |
| Redução | Ganho de elétrons; diminuição do número de oxidação (Nox). | O2 + 4e– → 2O2- | Diminuição do Nox (de 0 para -2) |
Número de Oxidação (Nox): O Que É Oxirredução: Número De Nox, Reações E Exemplos – Beduka
O número de oxidação (Nox), também conhecido como estado de oxidação, representa a carga que um átomo teria se todos os seus laços com átomos de elementos diferentes fossem 100% iônicos. É um conceito fundamental para entender reações de oxirredução, pois permite acompanhar a transferência de elétrons entre espécies químicas. A determinação do Nox segue um conjunto de regras que auxiliam na atribuição de cargas formais a cada átomo em uma molécula ou íon.A determinação do número de oxidação de um átomo em uma molécula ou íon envolve a aplicação de regras sistemáticas, levando em consideração a eletronegatividade dos elementos envolvidos e a carga total da espécie.
A soma dos Nox de todos os átomos em uma molécula neutra deve ser zero, enquanto em um íon, a soma dos Nox deve ser igual à carga do íon.
Determinação do Nox em Compostos Iônicos e Covalentes
Para compostos iônicos, o Nox de cada íon corresponde à sua carga. Por exemplo, no NaCl, o Nox do Na é +1 e o Nox do Cl é -1. Em compostos covalentes, a atribuição do Nox é mais complexa e requer a consideração da eletronegatividade. O átomo mais eletronegativo “recebe” os elétrons da ligação, obtendo um Nox negativo, enquanto o átomo menos eletronegativo “perde” elétrons, adquirindo um Nox positivo.
A regra prática é atribuir o Nox dos elementos mais eletronegativos primeiro, com base em suas cargas iônicas comuns. Por exemplo, em H₂O, o oxigênio (mais eletronegativo) recebe um Nox de -2, e cada hidrogênio recebe um Nox de +1, totalizando zero para a molécula.
Exemplos de Cálculo de Nox, O Que É Oxirredução: Número De Nox, Reações E Exemplos – Beduka
- MnO₄⁻ (íon permanganato): O oxigênio geralmente tem Nox -2. Como há quatro átomos de oxigênio, a contribuição total é -8. Para que a soma dos Nox seja igual à carga do íon (-1), o manganês (Mn) deve ter Nox +7. Portanto, Nox(Mn) = +7.
- H₂SO₄ (ácido sulfúrico): O hidrogênio tem Nox +1 (dois átomos, +2 no total). O oxigênio tem Nox -2 (quatro átomos, -8 no total). Para que a soma seja zero, o enxofre (S) deve ter Nox +6. Portanto, Nox(S) = +6.
- Cr₂O₇²⁻ (íon dicromato): O oxigênio tem Nox -2 (sete átomos, -14 no total). Para que a soma dos Nox seja igual à carga do íon (-2), os dois átomos de cromo (Cr) devem ter um Nox total de +12, resultando em +6 para cada átomo de cromo. Portanto, Nox(Cr) = +6.
Aplicação do Nox na Previsão de Reações de Oxirredução
O cálculo do Nox é crucial para identificar se uma reação é de oxirredução. Uma reação de oxirredução envolve a mudança do Nox de pelo menos um átomo. Se o Nox de um átomo aumenta, ele sofre oxidação (perda de elétrons); se diminui, sofre redução (ganho de elétrons).
- Reação entre zinco metálico e ácido clorídrico: Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g). O zinco metálico (Nox = 0) é oxidado para Zn²⁺ (Nox = +2), enquanto os íons H⁺ (Nox = +1) são reduzidos para H₂ (Nox = 0).
- Combustão do metano: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l). O carbono no metano (Nox = -4) é oxidado para CO₂ (Nox = +4), enquanto o oxigênio (Nox = 0) é reduzido para H₂O (Nox = -2).
- Reação entre permanganato de potássio e ácido oxálico: 2KMnO₄ + 5H₂C₂O₄ + 3H₂SO₄ → K₂SO₄ + 2MnSO₄ + 10CO₂ + 8H₂O. O manganês no permanganato (Nox = +7) é reduzido para Mn²⁺ (Nox = +2), enquanto o carbono no ácido oxálico (Nox = +3) é oxidado para CO₂ (Nox = +4).
Tipos de Reações e Exemplos Práticos de Oxirredução
As reações de oxirredução, também conhecidas como redox, são processos químicos fundamentais que envolvem a transferência de elétrons entre espécies químicas. Essa transferência resulta em alterações nos números de oxidação (Nox) dos átomos envolvidos, sendo a oxidação o aumento do Nox e a redução a diminuição do Nox. Diversos tipos de reações químicas podem ser classificadas como reações redox, apresentando características e aplicações distintas.Reações de oxirredução são onipresentes na natureza e na indústria, desempenhando papéis cruciais em processos biológicos, como a respiração celular, e em tecnologias como baterias e células de combustível.
Compreender seus mecanismos e tipos é essencial para a compreensão de diversos fenômenos químicos.
Reações de Combustão
A combustão é um tipo comum de reação de oxirredução que envolve a rápida reação de uma substância com um oxidante, geralmente o oxigênio (O₂), liberando calor e luz. Nesse processo, a substância combustível sofre oxidação, enquanto o oxigênio sofre redução. Um exemplo clássico é a combustão do metano (CH₄):
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Neste exemplo, o carbono no metano (Nox = -4) é oxidado a dióxido de carbono (Nox = +4), enquanto o oxigênio (Nox = 0) é reduzido a água (Nox = -2). A energia liberada na forma de calor e luz é a força motriz por trás de muitas aplicações, como a geração de eletricidade em usinas termoelétricas.
Reações de Síntese
Reações de síntese, onde duas ou mais substâncias se combinam para formar um único produto, podem também ser reações redox. Um exemplo é a formação de óxido de ferro (III) a partir de ferro metálico e oxigênio:
4Fe(s) + 3O₂(g) → 2Fe₂O₃(s)
Aqui, o ferro (Nox = 0) é oxidado a Fe₂O₃ (Nox = +3), e o oxigênio (Nox = 0) é reduzido a Fe₂O₃ (Nox = -2). Essa reação é responsável pela formação de ferrugem, um processo de corrosão que degrada o ferro.
Reações de Simples Troca

Em reações de simples troca (ou deslocamento), um elemento mais reativo desloca outro elemento menos reativo de um composto. Estas reações frequentemente envolvem a transferência de elétrons e, portanto, são reações redox. Um exemplo é a reação entre zinco metálico e solução de ácido clorídrico:
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
O zinco (Nox = 0) é oxidado a íons Zn²⁺ (Nox = +2), enquanto os íons H⁺ (Nox = +1) são reduzidos a gás hidrogênio (Nox = 0). Essa reação é uma reação redox que demonstra a maior reatividade do zinco em comparação com o hidrogênio.
Exemplos Práticos em Diferentes Contextos

A respiração celular, um processo vital para a obtenção de energia nos organismos vivos, é uma complexa série de reações redox. A glicose (C₆H₁₂O₆) é oxidada, enquanto o oxigênio é reduzido, produzindo dióxido de carbono, água e ATP (energia). A corrosão de metais, como a ferrugem mencionada anteriormente, é um processo redox que resulta na degradação de materiais metálicos devido à oxidação pelo oxigênio e água.
As baterias, por sua vez, utilizam reações redox para gerar eletricidade a partir de reações químicas espontâneas. Em uma bateria comum, a oxidação de um metal em um eletrodo e a redução de outro em um segundo eletrodo produzem uma corrente elétrica.
Etapas de uma Reação de Oxirredução Específica: Reação entre Cobre e Nitrato de Prata

A reação entre cobre metálico e nitrato de prata é um exemplo claro de reação redox. Vamos detalhar as etapas e as mudanças no Nox:
- Reagentes: Temos cobre metálico (Cu) e íons prata (Ag⁺) em solução aquosa de nitrato de prata (AgNO₃).
- Oxidação do Cobre: O cobre metálico perde dois elétrons, aumentando seu Nox de 0 para +2, formando íons Cu²⁺. Visualmente, podemos imaginar os átomos de cobre “perdendo” elétrons para a solução.
- Redução da Prata: Os íons prata (Ag⁺) ganham um elétron cada, diminuindo seu Nox de +1 para 0, formando átomos de prata metálica (Ag). Visualmente, podemos imaginar os íons prata “ganhando” elétrons e se depositando como metal sólido.
- Reação Global: A reação global é a soma da oxidação do cobre e da redução da prata:
Cu(s) + 2AgNO₃(aq) → Cu(NO₃)₂(aq) + 2Ag(s)
- Produto: O resultado é a formação de nitrato de cobre (II) em solução e a deposição de prata metálica sólida, observada como um revestimento prateado sobre o cobre.
Em resumo, a compreensão da oxirredução, incluindo o cálculo do Nox e a identificação dos agentes oxidantes e redutores, é essencial para a interpretação de inúmeros processos químicos. Desde a corrosão dos metais até a respiração celular, as reações redox desempenham um papel crucial. A capacidade de analisar e prever essas reações, com base na variação do Nox, fornece uma ferramenta poderosa para a compreensão e manipulação de processos químicos em diversos campos, incluindo a engenharia, a medicina e a indústria.

