Substâncias Simples e Compostas: Um mergulho no mundo das moléculas: De Exemplo De Substâncias Simples E Compostas Representando A Molécula

De Exemplo De Substâncias Simples E Compostas Representando A Molécula – E aí, pessoal! Vamos dar uma olhada no mundo microscópico da química, tipo, no nível dos átomos e moléculas. Vai ser maneiro entender a diferença entre substâncias simples e compostas, e como elas se comportam. Preparem-se para um “deep dive” no universo molecular!
Definição de Substâncias Simples e Compostas, De Exemplo De Substâncias Simples E Compostas Representando A Molécula
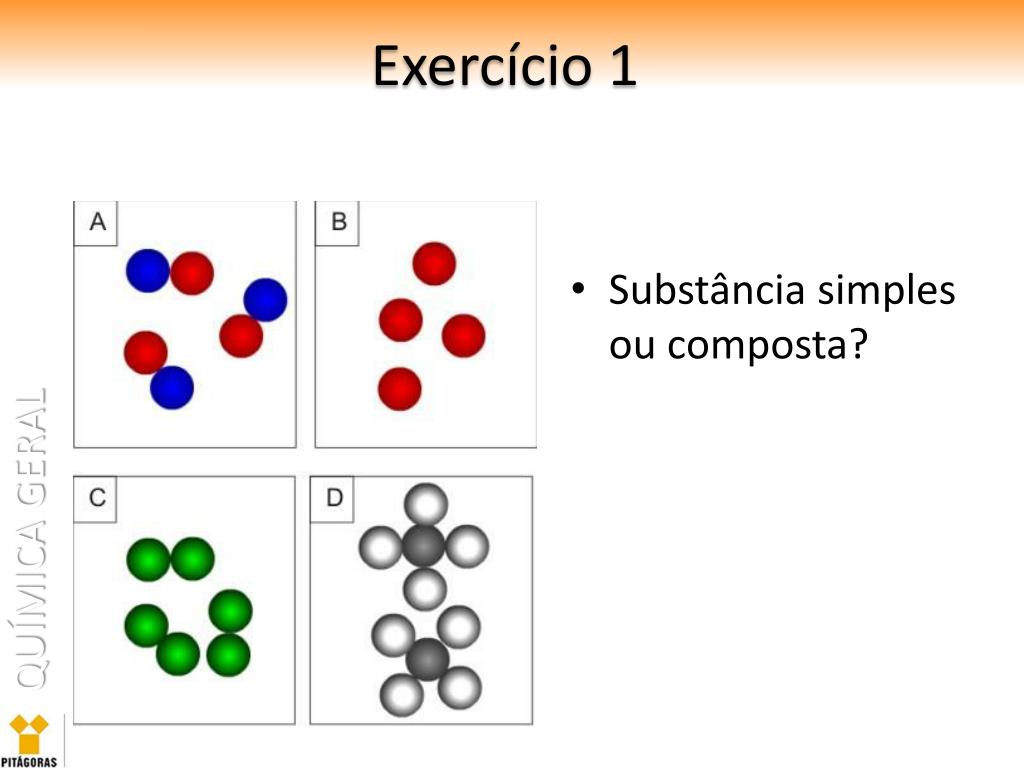
A vibe principal aqui é a diferença entre os tipos de átomos que formam uma substância. Substâncias simples são, tipo, um time só de átomos iguais, sabe? Já as compostas são um time misturado, com átomos diferentes se juntando em uma molécula. Super simples, né?
Aqui vão alguns exemplos de substâncias simples, com seus símbolos químicos e estados físicos em temperatura ambiente:
| Nome da Substância | Fórmula Química | Estado Físico (25°C) | Exemplo na Natureza |
|---|---|---|---|
| Oxigênio | O2 | Gasoso | Ar atmosférico |
| Nitrogênio | N2 | Gasoso | Ar atmosférico |
| Enxofre | S8 | Sólido | Depósitos minerais |
| Ferro | Fe | Sólido | Minério de ferro |
Agora, vamos ver alguns exemplos de substâncias compostas e suas aplicações:
- Água (H2O): Essencial para a vida, usada em tudo, desde beber até irrigação.
- Dióxido de carbono (CO2): Importante para a fotossíntese, mas também um gás estufa.
- Cloreto de sódio (NaCl): O sal de cozinha, usado em alimentos e na indústria.
- Glicose (C6H 12O 6): Fonte de energia para os seres vivos.
- Ácido sulfúrico (H2SO 4): Usado em baterias de carro e na indústria química.
Representação de Moléculas: Modelos e Fórmulas
Representar moléculas pode ser tipo, desenhar um mapa do seu time de átomos. Temos modelos 3D, que mostram a disposição espacial dos átomos, e fórmulas químicas, que mostram os tipos e quantidades de átomos. As fórmulas moleculares mostram o número total de cada átomo, enquanto as fórmulas estruturais mostram como os átomos estão ligados uns aos outros.
Em substâncias simples, a representação é mais “clean”, já que só tem um tipo de átomo. Em compostas, fica mais complexo, mostrando a interação entre os diferentes átomos.
A molécula de água (H 2O) tem uma geometria angular, com o átomo de oxigênio no centro e dois átomos de hidrogênio ligados a ele por ligações covalentes. A molécula de dióxido de carbono (CO 2) tem uma geometria linear, com o átomo de carbono no centro e dois átomos de oxigênio ligados a ele por ligações duplas covalentes.
Exemplos de Substâncias Simples e suas Moléculas
Vamos detalhar a estrutura de algumas substâncias simples!
O oxigênio (O 2) e o nitrogênio (N 2) têm ligações covalentes duplas e triplas, respectivamente, e geometria linear. O diamante e o grafite são ambos feitos de carbono (C), mas suas estruturas são bem diferentes.
As diferenças na estrutura do diamante e do grafite resultam em propriedades físicas distintas. O diamante, com sua estrutura tetraédrica tridimensional forte, é extremamente duro, enquanto o grafite, com sua estrutura em camadas, é macio e escamoso.
Algumas substâncias simples metálicas incluem:
- Ferro (Fe): Estrutura cúbica de corpo centrado, conhecido por sua resistência e ductilidade.
- Cobre (Cu): Estrutura cúbica de face centrada, excelente condutor de eletricidade.
- Alumínio (Al): Estrutura cúbica de face centrada, leve e resistente à corrosão.
Exemplos de Substâncias Compostas e suas Moléculas
A glicose (C 6H 12O 6) é um açúcar com vários grupos hidroxila (-OH) e um grupo carbonila (C=O), crucial para o metabolismo celular. O cloreto de sódio (NaCl) tem ligações iônicas, onde o sódio (Na) doa um elétron para o cloro (Cl), resultando em um sólido cristalino com alto ponto de fusão. O ácido sulfúrico (H 2SO 4) é um ácido forte, usado amplamente na indústria.
| Átomo | Número de Átomos | Tipo de Ligação | Ângulo de Ligação (aproximado) |
|---|---|---|---|
| H | 2 | Covalente | 104.5° |
| S | 1 | Covalente | – |
| O | 4 | Covalente | – |
Propriedades e Comportamento das Substâncias
Substâncias simples e compostas apresentam propriedades físicas bem diferentes. Por exemplo, o ponto de fusão e ebulição do oxigênio (substância simples) são muito mais baixos do que os da água (substância composta). A solubilidade também varia bastante. A estrutura molecular influencia diretamente nas propriedades. Uma reação química simples, como a combustão do metano (CH 4), um composto, com oxigênio (O 2), uma substância simples, produz dióxido de carbono (CO 2) e água (H 2O).
Qual a diferença entre uma fórmula molecular e uma fórmula estrutural?
A fórmula molecular indica apenas o tipo e número de átomos presentes na molécula (ex: H₂O). Já a fórmula estrutural mostra como os átomos estão ligados entre si, revelando a geometria molecular.
O que são alótropos?
Alótropos são formas diferentes de um mesmo elemento químico, com propriedades físicas distintas devido a diferentes arranjos atômicos. Exemplo: diamante e grafite (ambos formados por carbono).
Como a estrutura molecular afeta a solubilidade de uma substância?
A polaridade da molécula influencia sua solubilidade. Moléculas polares tendem a se dissolver em solventes polares (como água), enquanto moléculas apolares se dissolvem em solventes apolares.

