Teoria Ácido-Base de Brønsted-Lowry e a Reação entre Água e Ácido Clorídrico: Agua E Acido Cloridrico Bronsted E Lowry Exemplos De Reação
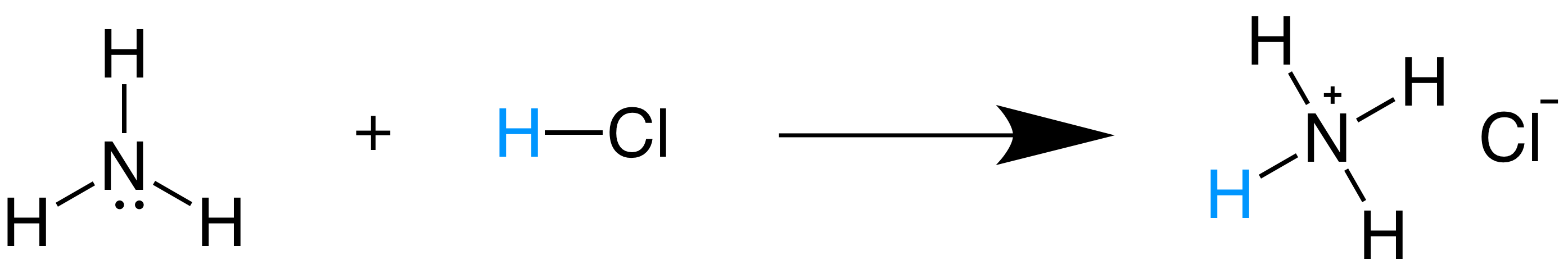
Agua E Acido Cloridrico Bronsted E Lowry Exemplos De Reação – A compreensão da teoria ácido-base é fundamental em química, permitindo a explicação de inúmeras reações e processos. Neste artigo, exploraremos a teoria de Brønsted-Lowry, focando na reação entre água e ácido clorídrico como exemplo central, e expandindo para outros exemplos e aplicações.
Introdução à Teoria Ácido-Base de Brønsted-Lowry
A teoria de Brønsted-Lowry define ácidos como espécies químicas que doam prótons (íons H +) e bases como espécies químicas que aceitam prótons. Esta definição amplia a teoria de Arrhenius, que limita ácidos e bases a substâncias que produzem íons H + e OH –, respectivamente, em solução aquosa. A teoria de Lewis, por sua vez, define ácidos como receptores de pares de elétrons e bases como doadores de pares de elétrons, abrangendo uma gama ainda maior de reações.
Em contraste com Arrhenius, Brønsted-Lowry inclui reações ácido-base em solventes não aquosos. Comparada à teoria de Lewis, Brønsted-Lowry é mais restritiva, focando especificamente na transferência de prótons. A reação entre HCl (ácido clorídrico) e H 2O (água) é um exemplo clássico: o HCl doa um próton para a água, atuando como ácido de Brønsted-Lowry, enquanto a água aceita o próton, atuando como base de Brønsted-Lowry.
- HCl(aq) + H 2O(l) → H 3O +(aq) + Cl –(aq)
- NH 3(aq) + H 2O(l) → NH 4+(aq) + OH –(aq)
- CH 3COOH(aq) + H 2O(l) → CH 3COO –(aq) + H 3O +(aq)
Reação entre Água e Ácido Clorídrico
A reação entre água e ácido clorídrico é uma reação de neutralização ácida completa. O ácido clorídrico, um ácido forte, doa prontamente um próton para a água, uma base fraca. Este processo resulta na formação de íons hidrônio (H 3O +) e íons cloreto (Cl –).
Na reação, o HCl atua como o ácido de Brønsted-Lowry, doando um próton, e a água atua como a base de Brønsted-Lowry, aceitando o próton. A água, neste caso, atua como uma base, pois recebe o próton do ácido clorídrico.
| Reagentes | Produtos | Ácido Conjugado | Base Conjugada |
|---|---|---|---|
| HCl, H2O | H3O+, Cl– | H3O+ | Cl– |
Exemplos Adicionais de Reações Ácido-Base com Água

A água pode atuar tanto como ácido quanto como base, dependendo da substância com a qual reage. Isso é conhecido como anfoterismo.
- Reação com amônia (NH3): A água atua como um ácido, doando um próton para a amônia, que atua como base. Ácido: H 2O; Base: NH 3; Ácido conjugado: NH 4+; Base conjugada: OH –.
- Reação com ácido acético (CH3COOH): A água atua como uma base, aceitando um próton do ácido acético. Ácido: CH 3COOH; Base: H 2O; Ácido conjugado: CH 3COO –; Base conjugada: H 3O +.
- Autoionização da água: A água reage consigo mesma, com uma molécula atuando como ácido e outra como base. Ácido: H 2O; Base: H 2O; Ácido conjugado: H 3O +; Base conjugada: OH –.
Força de Ácidos e Bases
O ácido clorídrico é considerado um ácido forte, dissociando-se completamente em água. Sua capacidade de doar prótons é muito alta, em comparação com ácidos fracos como o ácido acético, que se dissociam apenas parcialmente. A força de um ácido está diretamente relacionada à sua capacidade de doar prótons; ácidos fortes doam prótons facilmente, enquanto ácidos fracos doam prótons com mais dificuldade.
A estrutura molecular influencia a força ácida. Por exemplo, a presença de átomos eletronegativos próximos ao átomo de hidrogênio que será doado aumenta a força ácida, pois estabiliza a base conjugada.
Aplicações da Reação entre Água e Ácido Clorídrico, Agua E Acido Cloridrico Bronsted E Lowry Exemplos De Reação
A reação entre água e ácido clorídrico tem diversas aplicações práticas. Duas aplicações importantes são a produção de cloreto de sódio e a limpeza de superfícies.
- Produção de cloreto de sódio: A reação do ácido clorídrico com um hidróxido, como o hidróxido de sódio (NaOH), produz cloreto de sódio (NaCl), um composto amplamente utilizado na indústria e no cotidiano. O processo envolve uma reação de neutralização, onde o ácido reage com a base, liberando calor e formando sal e água. A reação é exotérmica, ou seja, libera calor durante o processo.
- Limpeza de superfícies: O ácido clorídrico diluído é utilizado na limpeza de superfícies, devido à sua capacidade de dissolver certos tipos de depósitos minerais e óxidos metálicos. O processo envolve a reação do ácido com o material a ser limpo, formando sais solúveis que são posteriormente removidos com água. A ação corrosiva do ácido precisa ser cuidadosamente controlada para evitar danos às superfícies.
Equilíbrio Químico na Reação
A reação entre água e ácido clorídrico, embora seja considerada completa para ácidos fortes, pode ser representada por uma constante de equilíbrio. Para a reação HCl(aq) + H 2O(l) ⇌ H 3O +(aq) + Cl –(aq), a expressão da constante de equilíbrio (K a) é dada por:
Ka = [H 3O +][Cl –]/[HCl]
Neste caso, para um ácido forte como o HCl, o valor de K a é muito grande, indicando que o equilíbrio está fortemente deslocado para a formação dos produtos. A temperatura afeta o equilíbrio, aumentando a constante de equilíbrio com o aumento da temperatura. A concentração dos reagentes e produtos também afeta o equilíbrio, de acordo com o princípio de Le Chatelier.
Compreender a reação entre água e ácido clorídrico, sob a lente da teoria de Brønsted-Lowry, é crucial para dominar os fundamentos da química ácido-base. De sua aplicação em inúmeros processos industriais à sua importância em sistemas biológicos, a interação entre esses dois compostos é um pilar da química moderna. Ao longo desta análise, exploramos o mecanismo da reação, identificamos os ácidos e bases conjugados, comparamos a força do ácido clorídrico com outros ácidos e, finalmente, analisamos as implicações do equilíbrio químico.
Esperamos que esta jornada tenha iluminado os conceitos-chave e despertado sua curiosidade para futuras explorações no mundo da química.

